
תוֹכֶן
אדנוקרצינומה ריאה היא סוג של סרטן ריאות תאים לא קטנים (NSCLC), הסוג הנפוץ ביותר של סרטן ריאות. NSCLCs מהווים 80% מממאירות הריאות, ומתוכם כ- 50% הם אדנוקרצינומות. כיום אדנוקרצינומה היא הצורה הנפוצה ביותר של סרטן ריאות בקרב נשים, אסיאתים ואנשים מתחת לגיל 45, ואף יכולה להשפיע על אנשים שאינם מעשנים מעולם לא עישנתי סיגריה אחת.בעוד ששיעור האדנוקרצינומה פחת אצל גברים והתייצב אצל נשים, המספרים ממשיכים לעלות בקרב נשים צעירות וחסרות עישון וחוקרים אינם לגמרי בטוחים מדוע. מקובל להאמין כי גנטיקה, עישון פסיבי ו חשיפה לרדון בבית הם כל הגורמים התורמים. למרבה הצער, מחקרים על הסיבות האפשריות לוקים בחסר, ככל הנראה בגלל העובדה שסרטן הריאות נחשב במידה רבה ל"מחלת מעשנים ".
מדוע סרטן ריאות מתגבר אצל מעשנים אף פעם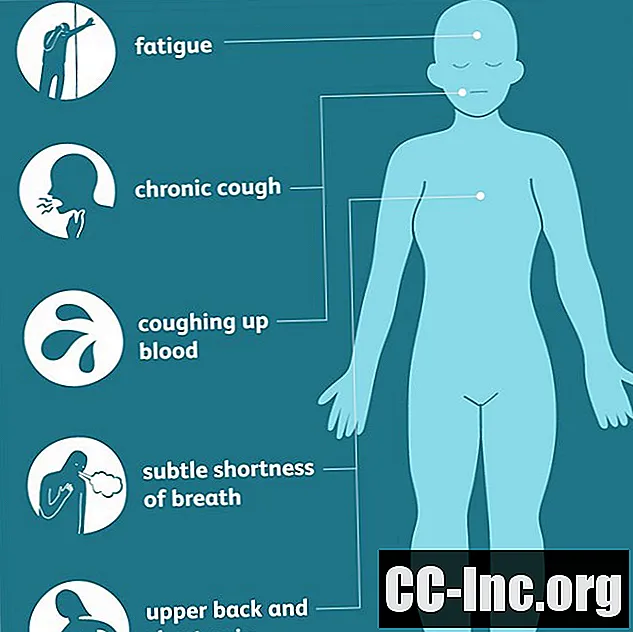
תסמינים של ריאות אדנוקרצינומה
אדנוקרצינומות ריאות מתחילות בדרך כלל ברקמות הסמוכות לחלק החיצוני של הריאות ועשויות להיות שם זמן רב לפני הופעת התסמינים. כאשר הם מופיעים לבסוף, הסימנים לעיתים קרובות ברורים פחות מצורות אחרות של סרטן ריאות, המתבטאים בשיעול כרוני ובליחה דמית רק בשלבים מאוחרים ומתקדמים יותר של המחלה.
מסיבה זו, חלק מהתסמינים המוקדמים הכלליים יותר (כגון עייפות, קוצר נשימה עדין או כאבי גב עליון וחזה) עשויים להחמיץ או לייחס אותם לסיבות אחרות. כתוצאה מכך, האבחנות מתעכבות לעיתים קרובות, במיוחד בקרב צעירים ושאינם מעשנים שאולי מעולם לא ראו בסרטן אפשרות או איום.
תסמינים של סרטן ריאות אצל לא מעשניםסיבות
כמו בכל סוגי הסרטן, הגורם לאדנוקרצינומה של הריאות נותר ברובו לא ידוע. מחקרים מראים כי גורמים גנטיים, סביבתיים ואורח חיים ממלאים חלק בהתפרצות המחלה, בסיכון ובחומרתה.
גנטיקה
כאחד משלושה תת-סוגים של NSCLC, סבור כי אדנוקרצינומה של הריאות קשורה למוטציות גנטיות מסוימות העלולות להטיל אדם על המחלה.
אלה כוללים מוטציה של גן הקולטן לגורם גדילת האפידרמיס (EGFR), המספק לגוף הוראות כיצד ליצור חלבונים מבניים ומווסת את המהירות בה מתרחש. ישנן לפחות 10 מוטציות ידועות שיכולות להשפיע על הגן ולגרום לתאים להשתכפל בצורה חריגה וללא שליטה.
מוטציות EGFR קשורות לרוב לאדנוקרצינומות פחות אגרסיביות בדרגה נמוכה עד בינונית.
מוטציות אחרות הקשורות לאדנוקרצינומה ריאתית כוללות את אלה המשפיעים על גן סרקומה של עכברוש קירסטן (KRAS). כמו EGFR, גם KRAS מווסת את צמיחת התאים, ההבשלה והמוות; מוטציות נראות ב -20% עד 40% ממקרי אדנוקרצינומה של הריאות.
עם זאת, לאנשים שלגידולים שלהם יש מוטציות של KRAS יש בדרך כלל פרוגנוזה גרועה. גם אם הסרטן מגיב היטב לכימותרפיה ראשונית, המחלה חוזרת כמעט תמיד.
מוטציות הקשורות לאדנוקרצינומה עוברות לעיתים מהורה לילד. סקירה ב -2017 בכתב העת מכתבים אונקולוגיים מצביע על כך שלידה של הורה או אח עם סרטן ריאות מגדילה את הסיכון למחלה ב -50% בהשוואה לאנשים ללא היסטוריה משפחתית.
מוטציות אחרות עלולות להתרחש באופן ספונטני; מדענים אינם בטוחים מדוע.
דאגות בריאות ואורח חיים
לגנטיקה יש רק חלק בסיכון לאדנוקרצינומה של הריאות. גורמים אחרים תורמים בצורה משמעותית, לא פחות מהם עישון טבק.
על פי המחקר הבריאותי האחיות הוותיק, אנשים שעישנו בין 30 ל -40 שנה הם בעלי סיכוי גבוה פי שניים לפתח אדנוקרצינומה ריאה מאלה שמעולם לא עישנו. הסיכון מוכפל עוד יותר אם עישנת יותר מ -40 שנה.
חשיפה לעישון פסיבי מגדילה גם את הסיכון שלך.
גורמים אחרים שמסכנים אותך לאדנוקרצינומה ריאה כוללים:
- זיהום אוויר, כולל אדי פיח ופליטה
- חשיפת ראדון בבית
- חשיפה תעסוקתית לחומרים מסרטנים כמו אסבסט או ארסן
- היסטוריה של מחלת ריאות, כולל מחלת ריאות חסימתית כרונית (COPD) ושחפת קשה (TB)
גורמי סיכון אלה ואחרים שאינם קשורים לעישון מסבירים מדוע 20% מסרטן הריאות מופיעים אצל אנשים שמעולם לא עישנו סיגריה בחייהם.
גורם וגורמי סיכון לסרטן ריאות תאים שאינם קטניםאִבחוּן
לעיתים קרובות סרטן ריאות מתגלה לראשונה כאשר חריגות נראות בצילום רנטגן, בדרך כלל בצורת צל מוגדר בצורה גרועה. תוך כדי מצוקה, הממצא מציע לפחות אפשרות לאבחון מוקדם.
בכ- 25% ממקרי סרטן הריאות, צילום רנטגן בחזה לא יגלה אי סדרים ויחזיר אבחנה "רגילה" לחלוטין.
אם יש חשד לסרטן, ניתן להשתמש באבחון אחר ורגיש יותר, כולל:
- טומוגרפיה ממוחשבת (סריקת CT), סריקת חזה שיכולה לזהות חריגות קטנות בהרבה מאשר צילום רנטגן בחזה
- הדמיית תהודה מגנטית (MRI), המשתמשת בשדות מגנטיים לעיבוד תמונות
- ברונכוסקופיה, הליך בו מוחדר היקף גמיש לגרון לבדיקה חזותית של דרכי הנשימה הגדולות בריאות
- טומוגרפיה של פליטת פוזיטרון (סריקת PET), אשר יכולים לדמיין אזורים של היפראקטיביות מטבולית (כגון שיכולים לקרות עם תאים סרטניים)
אם יש חששות מתמשכים לאחר צילום חזה, יש להזמין מחקרים נוספים.
ניתן להשתמש גם בציטולוגיה של כיח, בה מעריכים דגימה של רוק ושיעול שיעול, אך הדבר נחשב פחות שימושי באבחון סרטן מוקדם.
בהתאם לתוצאות, הרופא שלך עשוי לרצות לקבל דגימה של רקמת ריאה כדי לאשר את האבחנה. בנוסף לביופסיות רקמות ריאות פולשניות יותר, בדיקת דם חדשה יותר הנקראת ביופסיה נוזלית עשויה להיות מסוגלת לעקוב אחר הפרעות גנטיות ספציפיות בתאי סרטן ריאה כמו מוטציות EGFR.
כיצד מאבחנים סרטן ריאות שאינו קטןפרופיל גנטי
אחד ההתקדמות המרתקים יותר באונקולוגיה היה השימוש בבדיקות גנטיות לפרופיל תאים סרטניים. על ידי כך, רופאים יכולים לבחור טיפולים המסוגלים למקד את אותם וריאציות גנטיות ספציפיות.
ההנחיות הנוכחיות ממליצות לכל האנשים עם אדנוקרצינומה ריאה מתקדמת לבצע אימונוהיסטוכימיה של PD-L1 (PH-L1 IHC). בדיקה גנטית זו מתעדת את סרטן האדם ועוזרת לחזות את היעילות הפוטנציאלית של אחת מארבע התרופות החיסוניות שאושרו לטיפול במחלה.
עם זאת, בדיקות PD-L1 רחוקות מלהיות מושלמות בניבוי מי יגיב לתרופות אלו או לא. בדיקות אחרות, כמו נטל מוטציה של גידול (מספר המוטציות הקיימות בגידול) עשויות לסייע בזיהוי מי ירוויח יותר מטיפולים חדשים וממוקדים אלה.
סקירת הבדיקות המולקולריות וה- PD-L1 שלך היא אחד הצעדים החשובים ביותר כאשר מאובחנים לראשונה עם אדנוקרצינומה ריאתית. טיפולים ספציפיים זמינים לא רק לבעלי מוטציות EGFR אלא למוטציות אחרות הניתנות לטיפול, כגון BRAF, ERBB2, סידורים מחדש של ALK, ROS1 סידורים מחדש ואחרים.
סקירה כללית של בדיקות גנטיות לסרטן ריאותבימוי סרטן
לאחר אישור האבחנה לסרטן, הרופא יביים את המחלה על סמך סדרת בדיקות סטנדרטיות. מטרת הבימוי היא לקבוע עד כמה סרטן הריאות מתקדם ובאיזו מידה הוא התפשט (גרור).
בימוי מסייע בטיפול ישיר בצורה מתאימה יותר, כך שממאירות אינה מטופלת בצורה לא טובה (משפיעה על התוצאות) ואינה מטופלת יתר על המידה (גורמת לתופעות לוואי מיותרות).
אם תיק נשקל סרטן ריאות נסתר, המשמעות היא שתאים סרטניים נמצאים בליחה אך לא ניתן למצוא גידול ריאות במחקרי הדמיה. שלב 0 פירושו שהסרטן מוגבל לרירית דרכי הנשימה והוא עדיין לא פולשני.
מעבר לכך, ישנם ארבעה שלבים המוגדרים כדלקמן. מונחים אלה ישמשו בעת דיון באפשרויות הטיפול.
| מִיוּן | שלב / ים מקבילים | אפשרויות טיפול |
|---|---|---|
| סרטן ריאות בשלב מוקדם | שלב 1: מקומי ולא מתפשט לבלוטות לימפה שלב 2: התפשטות לבלוטות הלימפה, רירית הריאות או המעברים העיקריים שלהן | ניתן לריפוי אפשרי באמצעות ניתוח |
| סרטן ריאות מתקדם מקומי | שלב 3 א: התפשט לבלוטות הלימפה באותו צד של הגוף כמו הגידול, אך לא אזורים רחוקים | ניתוח אפשרי; בדרך כלל נדרש טיפול נלווה בכימותרפיה ובקרנות |
| סרטן ריאות מתקדם | • שלב 3B: התפשט לבלוטות הלימפה הרחוקות או לפלישה למבנים אחרים בחזה • שלב 4: התפשט לריאה השנייה, לאזור אחר בגוף, או לנוזל סביב הריאה או הלב | טיפולים שאינם ניתוחיים הם הטובים ביותר. כל המקרים הנדירים מלבד כמה נחשבים כבלתי ניתנים לפעולה. |
סקירה כללית על שלבי סרטן הריאותיַחַס
בהתאם לשלב המחלה, הטיפול עשוי לכלול טיפול אחד או שילוב.
- כִּירוּרגִיָה ניתן להציע בשלבים הראשונים, לבד או בליווי כימותרפיה ו / או טיפול בהקרנות. כאשר הוא מצליח, הניתוח מציע את הסיכוי הטוב ביותר לרפא סרטן ריאות.
- כימותרפיה ניתן להשתמש לבד, בשילוב עם טיפול בהקרנות, או לפני הניתוח או אחריו.
- טיפולים ממוקדים לתקוף מוטציות גנטיות ספציפיות על ידי זיהוי חלבונים ספציפיים בתאים סרטניים וחסימת יכולתם לשכפל. האפשרויות כוללות Tarceva (erlotinib), Iressa (gefitinib), Gilotrif (afatinib), Xalkori (crizotinib), Zykadia (ceritinib), Alecnensa (alectinib) ו- Tagrisso (osimertinib). עוד עוברים בדיקה קלינית.
- טיפול בקרינה יכול לשמש לטיפול בסרטן או לשלוט בסימפטומים אצל אלו הסובלים מסרטן גרורתי. ניתן להשתמש בצורות ממוקדות יותר של קרינה (טיפול בהקרנות סטריאו-טקטיות בגוף (SBRT), טיפול בפרוטונים) לסרטן קטן יותר שאיננו יכול להגיע אליו. SBRT משמש כעת גם לטיפול בגרורות מוחיות וגרורות אחרות בקרב אנשים הסובלים מסרטן ריאות, אם רק מעטים נמצאים.
- אימונותרפיה מטרתו לרתום את המערכת החיסונית של הגוף למלחמה בסרטן. האפשרויות הנוכחיות כוללות את אופדיבו (nivolumab), Keytruda (pembrolizumab), Tecentriq (atezolizumab) ו- Imfinzi (durvalumab) לסרטן ריאות בשלב 3 ו -4.
טיפולים ממוקדים הם כלליים פחות מטיפולים מהדור הקודם שתקפו תאים בריאים ולא בריאים, וכתוצאה מכך תופעות לוואי חמורות ואף בלתי נסבלות. ניסויים קליניים נמצאים בתהליך איתור מוטציות שכיחות יותר שניתן למקד לתרופות. תחום טיפול זה נמצא עדיין בחיתוליו ומתפתח במהירות.
ניסויים קליניים של טיפולים ממוקדים ואחרים מספקים תקווה לאלה בהם טיפולים מאושרים נכשלו או גרמו לתופעות לוואי קשות. ה- NCI ממליץ לאנשים עם סרטן ריאות לשקול לקחת חלק בניסוי קליני.
בעבר, הסבירות כי ניסוי קליני ישפיע על אדם חולה סרטן הייתה קטנה, אך זה משתנה במהירות כאשר מזוהים יעדים ספציפיים במסלול חלוקת תאים סרטניים. אנשים רבים עם סרטן ריאות בשלב 4 חיים רק בגלל השתתפותם בניסוי קליני.
לבסוף, רופאים רבים ממליצים לקבל חוות דעת שנייה ממומחה אחר או ממרכזי הטיפול המיועדים למכון לסרטן (NCI) המעורבים באופן פעיל בחקר סרטן הריאות. פעולה זו יכולה לעזור להבטיח שתקבל את המידע הטיפולי העדכני ביותר ותוכל טוב יותר לבחור בחירה מושכלת.
כיצד מטפלים בסרטן ריאות שאינו קטןמילה מ- Wellwell
מכיוון שלעתים קרובות קשה לזהות את הסימפטומים המוקדמים של סרטן הריאות, שיעור ההישרדות הממוצע לחמש שנים הוא רק סביב 18%. עבור המאובחנים בשלבים הראשונים, התחזית מבטיחה הרבה יותר.
מה שזה מדגיש הוא הצורך במודעות רבה יותר לגבי הסימפטומים הלא ספציפיים או הלא טיפוסיים של סרטן ריאות. בכוחות עצמם, קל מאוד להחמיץ את הסימפטומים. יחד, הם עשויים להניף דגל אדום שיכול להוביל לאבחון מוקדם ולטיפול מוקדם ויעיל יותר.
10 בתי החולים הטובים ביותר לסרטן בארה"ב